I den artikel, der henvises til her (New England Journal of Medicine, kræver registrering), fortæller FDA-chef Makary om en ny politik, hvormed lægemiddeludvikling vil blive fremskyndet.
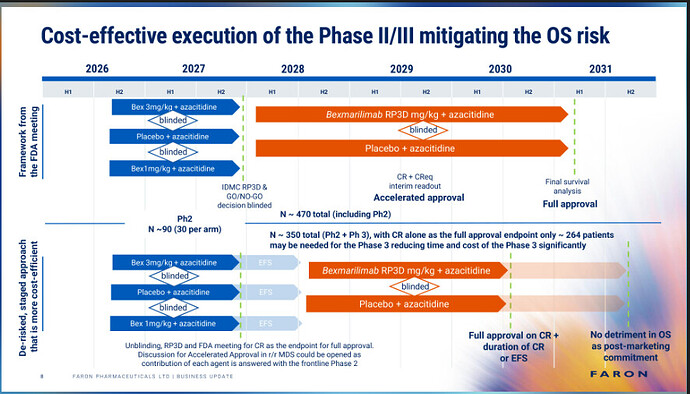
Det ser ud til, at dette allerede har været kendt hos Faron (fra Juhos seneste præsentation): det øverste diagram er FDA’s “gamle vejledning”, og det nederste diagram beskriver en ny, foreslået tilgang “De-risked, staged approach”, hvor overlevelse (OS) ikke længere vil stå i vejen for at opnå markedsføringstilladelse.
Med andre ord anerkendes også surrogat-endepunkter (for eksempel forbedring af blodværdier osv.) som bevis for lægemidlets effekt.
FDA siger, at den nye vejledning vil blive offentliggjort i løbet af foråret. Det må vi se, om Farons planer endnu en gang skal laves om. Ville dette være gode nyheder for Faron(?), det kræver i hvert fald igen en del fordybelse.